编者按:2021年6月9~17日,第26届欧洲血液学协会(EHA)年会将通过在线虚拟的方式隆重举行。为给广大血液学科医生提供更新鲜、更精彩、更丰富的学术大餐,《肿瘤瞭望》特别设置了“EHA五分钟”专题报道。我们邀请业内学术大咖分别在白血病、骨髓瘤、淋巴瘤等领域,精心挑选出该领域的重磅研究,并通过语音播报的形式,为广大读者进行全面而深入地介绍、解读与总结。本期我们特邀中国医学科学院血液病医院魏辉教授就急性髓系白血病(AML)领域的三项重磅研究,分别从新药疗效、维持治疗、治疗监测三个不同角度进行了详细解读。

维奈克拉联合吉瑞替尼治疗复发/难治FLT3突变急性髓系白血病的有效性和安全性评价:一项1b期研究的最新分析
Abstract #S135
Efficacy and Safety of Venetoclax in Combination with Gilteritinib for Relapsed/Refractory FLT3-Mutated Acute Myeloid Leukemia: Updated Analyses of a Phase 1b Study
与标准挽救性化疗相比,FMS-样酪氨酸激酶3(FLT3)抑制剂吉瑞替尼(Gilt)可改善FLT3突变(FLT3mut+)复发/难治性(R/R)急性髓系白血病(AML)患者的生存。该项多中心、开放标签的1b期临床试验显示,Gilt 联合 BCL-2抑制剂维奈克拉(Ven)在R/R FLT3mut+ AML患者中显示出较高比例的骨髓原始细胞清除,且改良复合完全缓解率(mCRc)为84%(Daver et al. ASH 2020; Abstract 333)。本次EHA大会上,研究者提供了Gilt+Ven在R/R FLT3mut+ AML中的1b期临床试验最新数据。
根据研究设计,在Ven剂量爬坡后,R/R FLT3mut+ AML患者在28天周期内接受最高每日400mg Ven联合Gilt(80mg或120mg)治疗。主要终点是mCRc(完全缓解[CR] +血小板未完全恢复的CR +血细胞计数未完全恢复的CR +形态性无白血病状态),与3期ADMIRAL试验CRc一致。mCRc的缓解持续时间(DOR)为次要终点,总生存期(OS)和FLT3等位基因负荷的变化为探索性指标。安全性评价包括不良事件(AE)监测。
截至2020年11月30日,本研究共纳入43名FLT3mut+患者。中位年龄(范围)63岁(23-85岁)。37例(86%)患者中发现了FLT3内部串联重复(ITD),6例(14%)患者仅存在酪氨酸激酶结构域(TKD)突变。基线细胞遗传学风险评估为2例低危(5%),23例中危(55%),13例高危(31%),5例(12%)没有分裂象/数据缺失。既往治疗线数的中位(范围) 2线(1-5线),33例(77%)接受过2线或更多线数的治疗。28例(65%)患者接受过至少一次FLT3抑制剂治疗,3例(7%)患者接受过Ven治疗。14例(33%)患者有移植史。
结果显示,42例(98%)报告3/4级不良事件(AEs)。34例患者(79%)出现了≥3级的血细胞减少,主要通过中断Ven和/或Gilt治疗和在后续的疗程中缩短Ven持续时间来处理。仅有的在>20%患者中报告的3/4级非血液学AEs是肺炎(n=9;21%)。肿瘤溶解综合征1例。共32例患者(74%)报告了严重的不良事件。30天和60天的死亡率分别为0%和12%。24名患者(56%)因AEs导致中断使用Ven或Gilt, 3名患者(7%)剂量减低, 6名患者(14%)停用。
86%(36/42) FLT3mut+AML患者获得mCRc,中位首次反应时间为1.0个月(范围:0.7-4.6),曾有FLT3酪氨酸激酶抑制剂(TKI)暴露史的患者中mCRc率为86%(24/28)。在基线和至少一个随访时间点进行PCR检测的mCRc患者中,69%(18/26)观察到FLT3分子学清除(<10-2)。DoR和OS总结见下表。
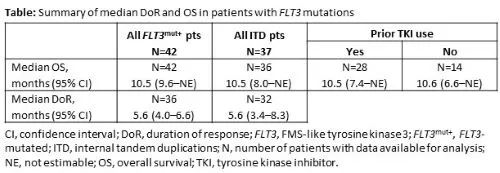
以上更新的数据显示,在接受过强烈预处理和既往TKI暴露的R/R FLT3mut+ AML患者中,Ven + Gilt仍可取得较高的mCRc率,并获得了令人鼓舞的分子学清除率。使用与既往研究相似的FLT3mut+群体应答标准,本研究报道的Ven + Gilt的高mCRc率反映强大的抗白血病活性。血细胞减少明显但可控。更新的随访和分子数据将在会议上提交。
点评
这是一项针对复发/难治FLT3突变阳性AML的临床试验。目前FLT3抑制剂吉瑞替尼已经在国内上市,其单药治疗复发/难治AML的总有效率约为三分之二。本研究将吉瑞替尼与BCL2抑制剂维奈克拉联合用于治疗复发/难治FLT3阳性AML。结果显示,总的复合CR率(mCRc)达到了86%(36/42),并且在既往有FLT3酪氨酸激酶抑制剂(TKI)暴露史的患者中也得到了相似疗效。
规范AML患者NGS-MRD检测标准:一项由ELN-MRD工作组开展的国际性研究
Abstract #S128
Standardizing NGS-MRD in AML: An International Study by the ELN-MRD Working party
微小残留病灶(measurable residual disease,MRD)检测被推荐用于AML患者强化化疗后的反应评估。然而,由于各个实验室检测MRD的方法不同,导致各个实验室之间的MRD结果不具有可比性。二代基因测序(next-generation sequencing,NGS)检测MRD,其敏感性和预测性较高。NGS-MRD在不同实验室的可再现性和可重复性尚未得到系统的研究。本研究评估了12个实验室的NGS- MRD分析的可重复性。
集中制备两组20例具有确定突变频率的DNA样本并运送到参与本研究的各个中心。Tru-Q7 DNA用于检测突变的IDH1、IDH2和KIT,使用患者样本或OCI-AML3细胞分别检测TP53突变和NPM1突变(在18个MRD阳性样本和2个MRD阴性样本中,共发现24个突变)。每个突变用3种不同的突变频率进行评估,突变频率范围为0.039%至1.55%)。
通过每个实验室使用各自的检测方法检测MRD,包括使用Illumina或Ion Torrent测序仪进行错误校正的靶向扩增子测序和髓系面板测序。第二组DNA采用之前发表的标准化方案进行检测(Thol et al. Blood 2018)。通过各个中心检测方法产生的数据由各中心生物信息学算法分析,通过标准化的中心流程产生的数据将统一分析,使用描述性统计来总结和比较结果。
结果显示,来自7个国家的12个实验室均提供了使用标准化方案检测得出的MRD数据,其中10个实验室同时提供了使用其本地检测方法得出的MRD数据。本地检测方法和标准化方案的检出限(the median limit of detection,LOD)分别为0.0752%(0.0031%-2.0%)和0.0053%(0.0006%-0.0507%)变异等位基因。本地检测方法和标准化方案的中位变异等位基因频率(variant allele frequency,VAF)分别为0.169%(0.0%-2.93%)和0.155%(0.007%-1.59%)。本地检测方法和标准化方案的目标VAFs的中位变异系数分别为57.3%(11.6% – 213.8%)和12.0%(4.0% – 102.4%)。使用本地本地检测方法,其中6个实验室的MRD检测灵敏度为100%,其余4个为38%-96%,使用标准化方案,12个实验室的MRD检测灵敏度均为100%。使用本地本地检测方法,其中7个实验室的MRD检测特异性为100%,其余3个为0%-50%,使用标准化方案,12个实验室的MRD检测特异性均为100%。
该项试验为首个针对AML患者NGS-MRD检测的国际实验室间测试。对于大多数参与本试验的实验室,其本地方案检测结果均具有高灵敏度和特异性。数据集中分析表明,标准化流程可以快速成功应用于各地实验室,使用标准化流程,NGS-MRD检测结果在多个中心之间具有较高的可再现性。
在AML的治疗中,MRD监测越来越受到重视。目前,国内采用的MRD常规检测方法包括聚合酶链反应(PCR)以及流式细胞术等方法。而由于NGS目前尚未在国内的临床实践中普遍使用,因此该技术尚不十分成熟。今年,欧洲血液学会就欧洲各个实验室使用NGS方法进行MRD监测的准确性和一致性进行了评估。通过评估发现,大多数实验室所采用的进行MRD监测的二代测序技术都具有较好的敏感性和特异性。此外,欧洲白血病网络工作组(ELN)还制定了一个二代测序技术监测MRD的标准化流程。依据该流程,各个实验室都能够达到较好的灵敏性和特异性,使得不同实验室的数据之间具有一致性和可比性。该研究为未来采用二代测序技术进行MRD监测提供了很好的基础,这也是目前首个针对就NGS-MRD监测的国际实验室评估和标准化进行的研究。
QUAZAR AML-001临床试验:口服阿扎胞苷治疗已达到缓解的不同亚组AML患者的生存结果
Abstract #S131
Survival Outcomes from the Quazar AML-001 Trial with Oral Azacitidine for Patients with Acute Myeloid Leukemia in Remission by Disease Subtype, Cytogenetic Risk, and NPM1 Mutation Status at Diagnosis
口服阿扎胞苷(oral azacitidine,Oral-AZA)在美国获批用于经强化化疗后首次达到完全缓解(complete remission,CR)或血计数恢复未完全恢复的完全缓解(Cri),且不符合再次强化治疗条件的AML成年患者。在III期QUAZAR临床试验中,与安慰剂相比,oral-AZA显著改善了AML患者的总生存期(overall survival,OS),其中位OS分别为24.7个月和14.8个月(P<0.001)。根据预后特征或突变特征,尚未阐明oral-AZA维持治疗可以使哪些患者亚组获益更多。
该项研究基于细胞遗传学风险分类、AML亚型(de novo或继发)以及诊断时NPM1突变状态,对数据进行事后分析,探讨了oral-AZA与生存期的关系。患者以1:1的比例随机分组,在达到初次CR/Cri后四个月内,分别予以oral-Oral-AZA 300 mg 或安慰剂。诊断时即确定NPM1/FLT3-ITD突变状态。采用Kaplan-Meier法评估OS和无复发生存期(relapse-free survival,RFS)。使用Cox比例风险回归法计算风险比(HR)。MRD分析采用0.1%的临界值(P值,Fisher精确检验)。
该研究共入组472例患者,其中90.9%为初发AML,与安慰剂组相比,oral-AZA显著延长了患者的OS,分别为23.2个月和14.6个月( HR=0.73;P=0.0068),RFS同样得到了显著延长,中位RFS分别为10.2个月和4.9个月( HR=0.66;P=0.0002)。对于43例继发AML患者,OS有延长的趋势,中位OS分别为28.2个月和15.7个月( HR=0.58;P=0.11),RFS显著延长,中位RFS分别为4.7个月和2.4个月(HR=0.47;P=0.0118)。
86%的患者为细胞遗传学中危患者,在这组患者中,与安慰剂组相比,oral-AZA组患者的OS显著延长,中位OS分别为25.4个月和15.9个月(HR=0.73;P=0.0093),RFS同样如此,分别为11.0个月和5.8个月(HR=0.66;P=0.0004)。细胞遗传学低危组患者占14%(66例),该组患者中,予以oral-AZA的患者与安慰剂组相比,OS同样具有延长的趋势,分别为13.9个月和7.4个月(HR=0.61;P=0.06),两组患者的中位RFS数据相似,oral-AZA组为4.6个月,安慰剂组为3.7个月(HR=0.63;P=0.08)。
29.2%的入组患者(137例)在诊断时具有NPM1突变,其中9.8%的患者(48例)为FLT3-ITD阳性,6%的患者(30例)为NPM1/FLT3-ITD 双突变。在安慰剂组中,NPM1突变为预后有利因素,突变组与非突变组的中位RFS分别为6.9 个月和4.6个月(HR 0.64;P=0.0083),中位OS分别为15.9个月和14.6个月(HR 0.75;P=0.10)。在NPM1突变亚组患者中,oral-AZA组的中位OS显著长于安慰剂组,分别为46.1个月和15.9个月( HR=0.57;P=0.0138),并且中位RFS显著延长,分别为23.2个月和6.9个月( HR=0.55;P=0.0098,如下图) 。

NPM1突变的患者中,MRD阴性患者的比例高于阳性患者,分别为61.7%和38.4%(P=0.0178)。对于NPM1未突变的患者(oral-AZA组170例,安慰剂组162例),oral-AZA显著延长其中位OS(19.6个月和14.6个月;HR=0.77;P=0.0365)和中位RFS(7.7个月和4.6个月;HR=0.69;P=0.0029)。该组患者MRD阴性和阳性的患者比例相当,分别为49.2%和50.8%。
Oral-AZA可显著延长初发AML和细胞遗传学中风险患者的生存期。此外,在QUAZAR AML-001试验中,oral-AZA组与安慰剂组相比,所有患者的中位OS延长了9.9个月,其中NPM1突变患者亚组的中位OS延长超过2.5年。这表明NPM1突变在一般情况下是预后的有利因素,并且是Oral-AZA延长OS的独立预测因素。
这项口头报告主要针对AML的维持治疗。既往研究已经证实,oral-AZA用于老年AML患者的维持治疗能够改善患者的预后。今年,这项研究进一步更新了后续数据分析,也进一步肯定了既往的研究结果。所有患者都能够从oral-AZA的维持治疗中获益,中位OS延长了9.9个月,总体患者的OS都得到延长。尤其是亚组分析结果显示,NPM1突变阳性的AML患者的中位OS延长超过2.5年。因此,NPM1突变阳性AML患者在oral-AZA维持治疗中获益更加明显。





 京公网安备 11010502033352号
京公网安备 11010502033352号